
Ongeveer 75% van de borstkankersoorten zijn positief voor de oestrogeenreceptor (ER) en/of progesteronreceptor (PR) 1,2,3. Van deze twee is oestrogeen het belangrijkste vrouwelijke hormoon dat de groei van borstkanker stimuleert. ER-positieve kankercellen hebben hun oestrogeenreceptoren op het celoppervlak, en wanneer deze receptoren geactiveerd worden door oestradiol (een soort circulerend oestrogeenhormoon), vermenigvuldigen cellen zich (prolifereren) en daardoor groeit de kanker4. Zowel tamoxifen als aromataseremmers (AI’s) zijn hormonale therapieën die worden gebruikt bij de behandeling van oestrogeen-positieve (ER-positieve) borstkanker om tumorgroei en terugkeer te stoppen.
Waar wordt oestrogeen geproduceerd?
Bij premenopauzale vrouwen wordt oestrogeen voornamelijk geproduceerd door de eierstokken. Voor iedereen, inclusief mannen, wordt echter ook een kleine hoeveelheid oestrogeen geproduceerd in andere weefsels, zoals in vetcellen, de borst, het bot, de lever en de hersenen5. In dit geval wordt het enzym aromatase gebruikt om andere hormonen (zoals testosteron) om te zetten in oestradiol. Na de menopauze is er geen oestrogeenproductie meer in de eierstokken, maar de aromatase-activiteit blijft bestaan, dus oestrogeen is nog steeds aanwezig.
Hoe werkt Tamoxifen?
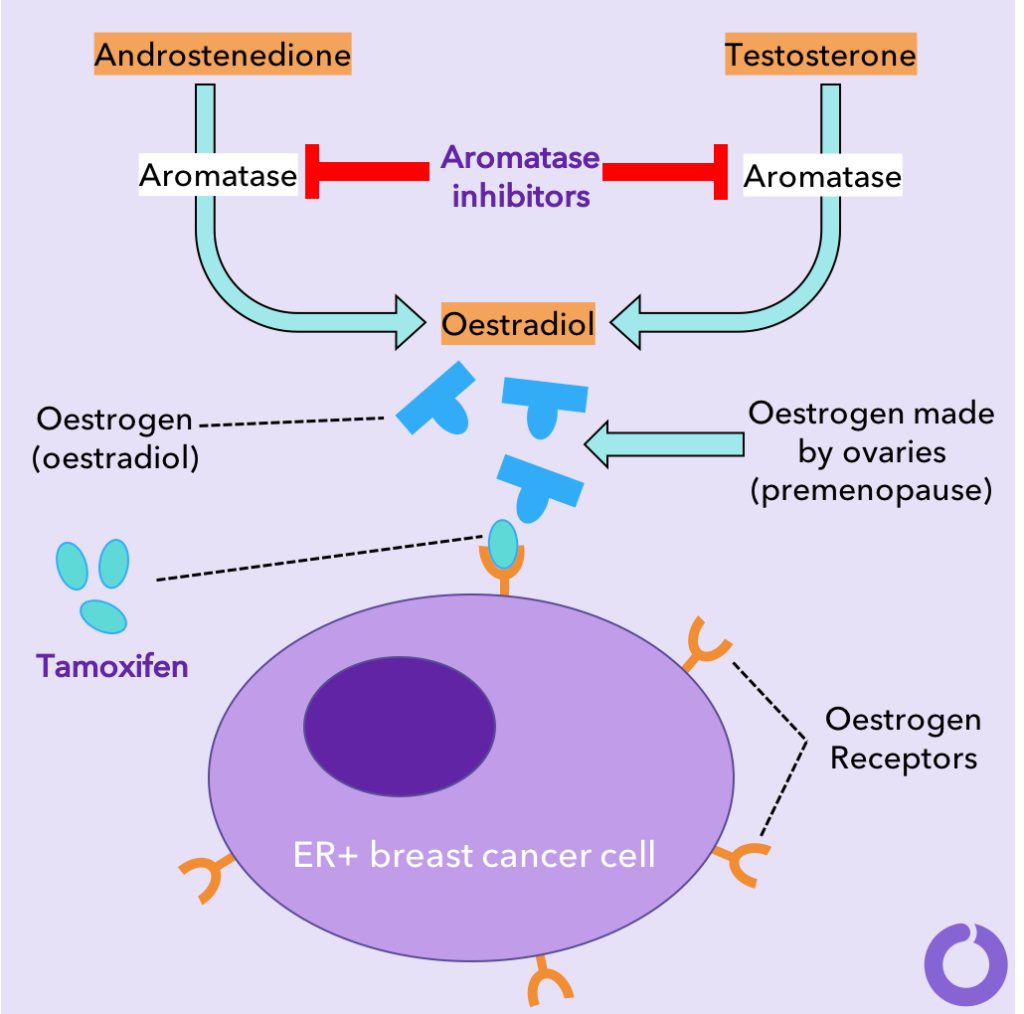
Tamoxifen was de eerste specifieke hormoontherapie die werd gebruikt bij de behandeling van borstkanker en die significant klinisch succes vertoonde6. Dit medicijn wordt gebruikt bij de behandeling van premenopauzale en postmenopauzale vrouwen, evenals mannen bij wie borstkankerbiopsieën verhoogde niveaus van de oestrogeenreceptor vertoonden. Tamoxifen blokkeert de oestrogeenreceptoren op de kankercellen. Op deze manier is oestradiol nog steeds in normale hoeveelheden in het lichaam aanwezig, maar kan het de kankercellen niet activeren om verder te groeien (zie diagram).
Sommige ER-positieve patiënten reageren echter niet op tamoxifen, of ze kunnen resistent worden. Hoewel de mechanismen om de resistentie tegen tamoxifen te verklaren onduidelijk blijven, is een van de hypothesen dat wanneer cellen dit medicijn “beu” zijn, ze soms reageren door de expressie van het gen “AKT” te verhogen. Dit is een overlevingsgen dat helpt bij het stimuleren van celgroei en -proliferatie in normale situaties. Bij borstkanker kan het AKT-gen overactief worden en resistentie verlenen door ervoor te zorgen dat kankercellen de oestrogeenreceptor kunnen blijven gebruiken, zelfs in aanwezigheid van tamoxifen7. Een andere hypothese waarom sommige patiënten mogelijk geen baat hebben bij tamoxifen, is vanwege het enzym CYP2D6. Dit enzym zet tamoxifen om in een actieve vorm en ongeveer 10% van de mensen heeft een CYP2D6-enzym dat niet goed werkt8. Het hebben van een abnormaal CYP2D6-enzym kan ervoor zorgen dat tamoxifen oestrogeenreceptoren en de groei van kanker niet kan blokkeren.
Hoe werken Aromataseremmers?
Aan de andere kant worden aromataseremmers (AI’s) gebruikt om postmenopauzale vrouwen en mannen met ER-positieve borstkanker te behandelen. AI’s voorkomen dat het enzym aromatase zijn werk doet door andere hormonen om te zetten in oestradiol, waardoor de productie van oestradiol wordt gestopt (zie diagram). Deze remmers zijn veel effectiever dan tamoxifen bij postmenopauzale vrouwen9,10. De reden waarom AI’s niet worden gebruikt bij premenopauzale borstkankerpatiënten, is dat ze de oestradiolproductie in de eierstokken niet kunnen blokkeren. Een premenopauzale vrouw kan echter worden behandeld met de aromataseremmer exemestaan als hun ovariële functie wordt onderdrukt door geneesmiddelen zoals gosereline11. Letrozol, anastrozol en exemestaan zijn AI’s van de derde generatie en verlagen het circulerende oestrogeen vaak tot niet-detecteerbare niveaus12 waardoor de proliferatie en groei van tumoren wordt verminderd13. Het responspercentage varieert echter van 35% tot 70% bij primaire borstkanker en kan lager zijn bij vergevorderde kanker14.
Houd de bijwerkingen van je hormoontherapie bij met OWise
Hormonale therapieën kunnen meerdere bijwerkingen veroorzaken. Enkele van de meest voorkomende zijn bot- en gewrichtspijn, opvliegers, misselijkheid, vermoeidheid, stemmingswisselingen, hoofdpijn, obstipatie, droge huid en verlies van libido. Met OWise kun je ze in de loop van de tijd volgen en je welzijnsgegevens delen met jezelf, artsen en dierbaren.
Probeer het bijhouden van bijwerkingen uit en laat ons weten of dit artikel je heeft geholpen. Heb je opmerkingen of suggesties?
[1] Nadji M, Gomez-Fernandez C, Ganjei-Azar P, Morales AR. Immunohistochemistry of estrogen and progesterone receptors reconsidered: experience with 5,993 breast cancers. Am J Clin Pathol. 2005; 123:21–27.
[2] Lange CA, Yee D. Progesterone and breast cancer. Womens Health (Lond) 2008; 4:151–162.
[3] Moelans CB, de Ligt J, van der Groep P, Prins P, Besselink N, Hoogstraat M, ter Hoeve N, Lacle M, Kornegoor R, van der Pol C, de Leng W, Barbe E, van der Vegt B, Martens J, Bult P, Smits VT, Koudijs M, Nijman I, Voest E, Selenica P, Weigelt B, Reis-Filho J, van der Wall E, Cuppen E, van Diest PJ. The molecular genetic make-up of male breast cancer. Endocr Relat Cancer. 2019
[4] Johnston SRD and Dowsett M. Aromatase Inhibitors for breast cancer: Lessons from the laboratory. Nature Reviews, 2003; 3: 821-831
[5] Bulun SE, Lin Z, Imir G, Amin S, Demura M, Yilmaz B, Martin R, Utsunomiya H, Thung S, Gurates B, et al. Regulation of aromatase expression in estrogen-responsive breast and uterine disease: from bench to treatment. Pharmacological Reviews. 2005; 57:359–383
[6] Jordan VC, Brodie AM. Development and evolution of therapies targeted to the estrogen receptor for the treatment and prevention of breast cancer. Steroids. 2007; 72:7–25.
[7] Bostner J, Karlsson E, Pandiyan MJ, Skoog L, Fornancder T, Nordenskjold B, Stal O. Activation of Akt, mTOR, and the estrogen receptor as a signature to predict tamoxifen treatment benefit. Breast Cancer Res Treat. 2013;137(2):397-406.
[8] Goetz MP, Kamal A, Ames MM. Tamoxifen pharmacogenomics: the role of CYP2D6 as a predictor of drug response. Clin Pharmacol Ther. 2008;83(1):160-6.
[9] Geisler J, King N, Dowsett M, Ottestad L, Lundgren S, Walton P, Kormeset PO, Lonning PE. Influence of anastrozole (Arimidex), a selective, non-steroidal aromatase inhibitor, on in vivo aromatisation and plasma oestrogen levels in postmenopausal women with breast cancer. Br J Cancer. 1996; 74:1286–1291.
[10] Geisler J, King N, Anker G, Ornati G, Salle ED, Lonning PE, Dowsett M. In-vivo inhibition of aromatization by exemestane, a novel irreversible aromatase inhibitor, in post-menopausal breast cancer patients. Clinical Cancer Research. 1998; 4: 2089-2093.
[11] Francis PA, Regan MM, Fleming GF, Láng I, Ciruelos E, Bellet M, Bonnefoi HR, Climent MA, Da Prada GA, Burstein HJ, Martino S, Davidson NE, Geyer CE Jr, Walley BA, Coleman R, Kerbrat P, Buchholz S, Ingle JN, Winer EP, Rabaglio-Poretti M, Maibach R, Ruepp B, Giobbie-Hurder A, Price KN, Colleoni M, Viale G, Coates AS, Goldhirsch A, Gelber RD; SOFT Investigators; International Breast Cancer Study Group. Adjuvant ovarian suppression in premenopausal breast cancer. N Engl J Med. 2015 Jan 29;372(5):436-46.
[12] Geisler J, Haynes B, Anker G, Dowsett M, Lønning PE. Influence of letrozole and anastrozole on total body aromatization and plasma estrogen levels in postmenopausal breast cancer patients evaluated in a randomized, cross-over study. J Clin Oncol. 2002, 20: 751-757.
[13] Miller WR, Jackson J. The therapeutic potential of aromatase inhibitors. Expert Opin Investig Drugs. 2003, 12: 1-12. 10.1517/13543784.12.1.1.
[14] Smith IE, Dowsett M, Ebbs SR, Dixon JM, Skene A, Blohmer JU, Ashley SE, Francis S, Boeddinghaus I, Walsh G, IMPACT Trialists Group. Neoadjuvant treatment of postmenopausal breast cancer with anastrozole, tamoxifen, or both in combination: the Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen (IMPACT) multicenter double-blind randomized trial. J Clin Oncol. 2005, 23: 5108-5116.
